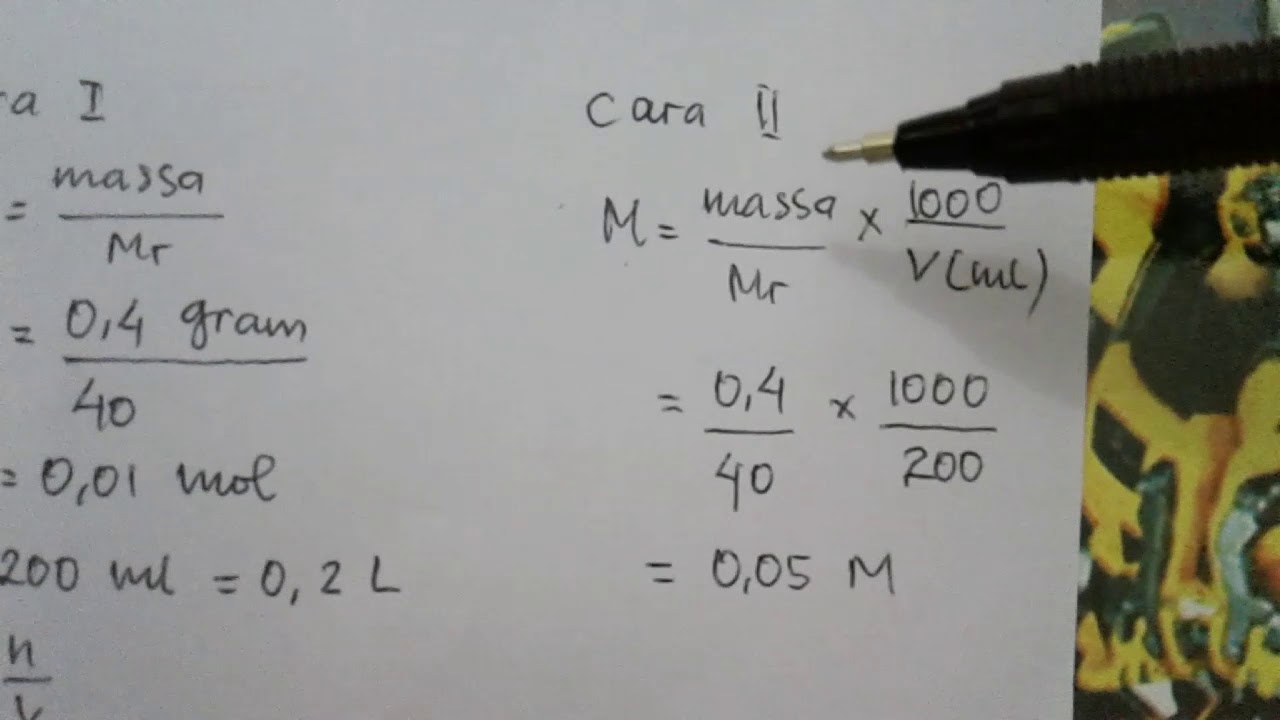
Menghitung Kemolaran ( Stoikiometri) YouTube
Contoh Soal Molalitas : Fraksi Mol, Rumus dan Penyelesaiannya. Kemolalan atau molalitas adalah konsentrasi larutan yang menyatakan jumlah mol (n) zat terlarut dalam 1 kg atau 1000 gram pelarut. Perbedaan molalitas dan molaritas yaitu jika molalitas adalah kemolalan atau konsentrasi molal (m) menyatakan banyaknya mol zat terlarut dalam 1000.

suatu larutan mengandung 425 gram H2SO4. berat jenis larutan 1.2875 g
Jika rumus molekul formalin adalah CH2O, molalitas larutan tersebut sebesar? Suatu larutan diperoleh dengan melarutkan 11,7 gram NaCl ke dalam 800 gr air, hitunglah kemolalan larutan tersebut! Hitung Mr zat terlarut jika 0,224 gram terlarut dalam 17 gram pelarut menghasilkan larutan dengan konsentrasi 0,0161 molal!

Kemolaran
Seperti soal sebelumnya, kita gunakan terlebih dahulu rumus mol namun terhadap volume gas STP. Selanjutnya kita bisa masukan ke dalam persamaan. Massa senyawa = Mr x Jumlah mol. 4,25 g = Mr x 0,125 mol. Mr = 34. Jadi, diketahui Mr dari 4,25 g gas dengan volume 2,8 L sebesar 34.

10 Rumus Bangun Datar Luas Keliling Dan Contoh Soal Riset
Rumus Kemolaran ASTALOG.COM - Molaritas atau kemolaran (M) adalah satuan konsentrasi larutan yang menyatakan banyaknya mol zat terlarut dalam 1 liter larutan. Kemolaran (M) sama dengan jumlah mol (n) zat terlarut dibagi volume (v) larutan. Kemolaran (Molaritas) dinyatakan dengan lambang M, adalah jumlah mol zat terlarut dalam setiap liter larutan.

Kimia Perbedaan mol,molaritas dan kemolalan YouTube
Kemolaran merupakan banyaknya mol zat terlarut dalam setiap liter larutan serta dinotasikan dengan huruf "M". Harga kemolaran tersebut bisa ditentukan dengan cara menghitung mol zat terlarut dengan volume larutan.

Hitunglah Kemolalan Larutan Cuka Yang Mengandung 24 Massa Ch3cooh
Secara matematis rumus dari molalitas adalah sebagai berikut. Keterangan: m = molalitas (mol/kg) Mr = massa molar zat terlarut (g/mol) massa = massa zat terlarut (gram) p = massa zat pelarut

Contoh Soal Kemolalan Kelas 12 Pembelajaran Siswa
Rumus kemolaran adalah:kemolaran = massa zat terlarut (g) / volume larutan (L) x massa molar zat terlarut (g/mol)Contohnya, jika kita memiliki 90 gram gula dalam 1 liter air dan massa molar gula adalah 342,3 g/mol, maka kemolaran gula adalah 0,262 M. Perbedaan Antara Kemolalan dan Kemolaran
dio ersa putra Larut dan Pelarut Kimia
1 Rumus Molalitas 1.1 Hubungan Molalitas dengan Persen massa 2 Fraksi Mol 2.1 Fraksi mol zat terlarut (Xt) 2.2 Fraksi mol zat pelarut (Xp) 3 Contoh Soal Molalitas dan Penyelesainya Rumus Molalitas Keterangan m = molalitas (mol/kg) g = gram zat terlarut (g) Mm = massa molar zat (g/mol) P = massa zat pelarut (g) Hubungan Molalitas dengan Persen massa

Rumus Menghitung Harga Saham Penutupan My XXX Hot Girl
Rumus fraksi mol zat pelarut. Zat pelarut adalah suatu zat yang dapat melarutkan bahan lain dan membentuk campuran atau larutan. Biasanya, zat pelarut merupakan zat cair baik yang bersifat polar maupun non polar. Rumus fraksi mol zat pelarut adalah: Dengan, xp: fraksi mol zat pelarut. np: jumlah mol zat pelarut.

Kemolalan Suatu Larutan 10 Massa Urea Mr 60 Adalah sisi tegak pada
100, 0128 ∘ C. 5. 100, 0234 ∘ C. Belajar Modul, Rumus, & Soal Sifat Koligatif Larutan dan kuis interaktif. Dapatkan Modul, Rumus, & Soal Sifat Koligatif Larutan lengkap di Wardaya College.

Rumus titik beku larutan
Molalitas (M) = jumlah mol zat pelarut / 1 kg zat pelarut. M = g/Mm x 1000/p Dengan keterangan : M = molalitas (mol/kg) g = gram zat terlarut (g) Mm = massa molar zat (g/mol) P = massa zat pelarut (g)

Latihan 6.6 Tentang Kemolalan dan Fraksi Mol Bab 6 Stoikiometri Kimia X
Home » Matematika » Fraksi Mol Kimia - Xi - Rumus, Penjelasan, Contoh Soal dan Jawaban. Fraksi Mol Kimia - Xi - Rumus, Penjelasan, Contoh Soal dan Jawaban. 07/08/2019 5 min read. Fraksi Mol dalam Kimia. Fraksi mol adalah ukuran konsentrasi larutan yang menyatakan perbandingan jumlah mol sebagian zat terhadap jumlah mol total komponen.

Kemolalan Suatu Larutan 10 Massa Urea Mr 60 Adalah sisi tegak pada
Banyaknya atom atau partikel yang terdapat dalam 12 gram C-12 adalah 6, 02 × 1023 partikel yang disebut dengan tetapan Avogadro yang dinyatakan dengan simbol L atau NA. Sehingga hubungan jumlah partikel suatu zat (N) dengan mol dapat dinyatakan sebagai berikut: N = L × n = 6, 02 × 1023 × n Massa atom relatif ( Ar)

Rumus Molaritas RUANG BACA
Kemolalan memuat informasi tentang jumlah zat terlarut dan pelarut sehingga mudah dipakai untuk menghitung fraksi mol, jika kerapatan larutan diketahui. Nilai kemolalan dapat pula digunakan untuk menghitung nilai kemolaran.. Rumus Menentukan Jumlah Massa Zat Ditambahkan Untuk Membuat Normalitas Larutan.

Rumus Keliling Dan Luas Lingkaran Beserta Contoh Soalnya
Kemolalan ( m) merupakan perbandingan antara jumlah mol zat terlarut dengan massa (kg) zat pelarut. Secara matematik dapat di rumuskan sebagai berikut : Keterangan : m = molalitas n = mol zat terlarut p = massa za pelarut (gram)

Rumus Torsi/ Momen Gaya (2)
Hubungan antara titik beku larutan dan kemolalan ini dapat dituliskan pada rumus berikut ini. Jika dijabarkan, maka rumus hubungan antara titik beku larutan dan kemolalan ini akan terlihat seperti berikut ini. ΔT f = K f x massaMr x 1.000P: Keterangan: massa = massa zat terlarut (gram)